



Next: KemiF, 1994
Up: hpage
Previous: KemiF, jan. 1996
Contents
Eksamensopgaver i Kemi A
21. December 1995
Opgave 1
Hvilken struktur har HCN molekylet ? Begrund svaret og redegør
for bindingstyper.
Opgave 2
CO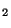 har 4 vibrations-svingninger, idet bøjnings-svingningen
er dobbelt udartet. De tre frekvenser er: symmetrisk stræk
har 4 vibrations-svingninger, idet bøjnings-svingningen
er dobbelt udartet. De tre frekvenser er: symmetrisk stræk
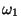 =1354 cm
=1354 cm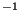 , bøjnings-svinging
, bøjnings-svinging 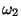 = 673 cm
= 673 cm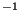 og asymmetrisk stræk
og asymmetrisk stræk 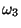 =2396 cm
=2396 cm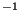 . Hvilket bidrag
til varmekapaciteten
. Hvilket bidrag
til varmekapaciteten 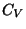 (i enheder af
(i enheder af 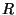 )
får man fra de tre vibrations-frihedsgrader ved 1000 K ? Hvilken
værdi har
)
får man fra de tre vibrations-frihedsgrader ved 1000 K ? Hvilken
værdi har 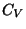 i højtemperaturgrænsen (der ses bort
fra bidraget fra de elektroniske frihedsgrader) ?
i højtemperaturgrænsen (der ses bort
fra bidraget fra de elektroniske frihedsgrader) ?
Opgave 3
Ved 300 K er 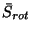 =41.14 J mol
=41.14 J mol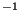 K
K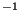 for nitrogen.
Beregn bindingslængden i nitrogen.
for nitrogen.
Beregn bindingslængden i nitrogen.
Opgave 4
Beregn 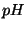 i følgende opløsninger:
i følgende opløsninger:
a) 0.10 M CH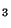 CH(NH
CH(NH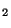 )COOH (alanin)
)COOH (alanin)
b) 0.01 M CH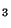 COCOOH (pyrodruesyre)
COCOOH (pyrodruesyre)
c) 0.001 M Pyrodruesyre
d) En blanding af 10.0 ml 0.100 M glycin CH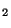 (NH
(NH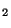 )COOH og
10.0 ml 0.080 M NaOH
)COOH og
10.0 ml 0.080 M NaOH
e) En blanding af 10.0 ml 0.100 M glycin og 10.0 ml 0.100 M NaOH
Opgave 5
1-Brompropan reagerer med thiosulfat i svagt basisk opløsning efter
skemaet:
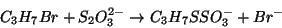 |
(33) |
Reaktionsforløbet følges ved at bestemme thiosulfat-koncentrationen
ved titrering med iod. Herved finder man følgende værdier
af thiosulfat:
|
t/s |
![$[S_2O_3^{2-}]$](img216.gif) /M /M |
|
0 |
0.1000 |
|
2.01 |
0.0750 |
|
5.05 |
0.0548 |
|
11.23 |
0.0353 |
a) Beregn hastighedskonstanten, idet begyndelseskoncentrationen
af 1-brompropan er 0.100 mol/l.
b) Hvor lang tid går der, før koncentrationen af 1-brompropan
er faldet til halvdelen af den oprindelige værdi ?
Opgaven kan evt. løses ved anvendelse af vedlagte millimeter-papir.
Opgave 6
Oxidation af ethanal (CH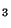 CHO) til eddikesyre eller acetation
(CH
CHO) til eddikesyre eller acetation
(CH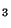 COO
COO ) under samtidig reduktion af jern(III) til jern(II)ion
kan realiseres i følgende elektrokemiske celle:
) under samtidig reduktion af jern(III) til jern(II)ion
kan realiseres i følgende elektrokemiske celle:
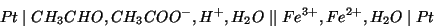 |
(34) |
a) Opskriv de to elektrodeprocesser samt celleprocessen.
b) Beregn den elektromotoriske kraft ved 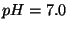 og følgende
koncentrationsforhold:
og følgende
koncentrationsforhold:
![$[CH_3CHO]/[CH_3COO^-]=10$](img219.gif) samt
samt
![$[Fe^{2+}]/[Fe^{3+}]$](img220.gif) =100.
=100.
c) Er celleprocessen frivillig ved disse koncentrationer ?
d) Idet 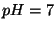 og
og
![$[Fe^{2+}]/[Fe^{3+}]$](img220.gif) =100 skal
=100 skal
![$[CH_3CHO]/[CH_3COO^-]$](img222.gif) beregnes ved ligevægt.
beregnes ved ligevægt.
e) Bestem ligevægtskonstanten for celleprocessen ved 298 K.
Tabel over pK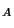 værdier værdier |
|
|
Stof |
pK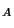 |
Alaniniumionen CH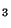 CH(NH CH(NH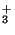 )COOH )COOH |
2.35 |
Alanin CH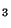 CH(NH CH(NH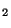 )COOH )COOH |
9.87 |
Pyrodruesyre CH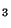 COCOOH COCOOH |
2.49 |
Glyciniumionen CH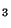 (NH (NH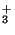 )COOH )COOH |
2.35 |
Glycin CH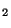 (NH (NH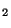 )COOH )COOH |
9.78 |
|
Reduktionsproces |
E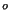 |
Fe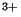 +e +e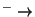 Fe Fe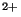 |
0.771 V |
CH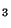 COO COO +3H +3H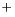 +2e +2e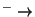 CH CH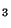 CHO+H CHO+H O O |
-1.089 V |




Next: KemiF, 1994
Up: hpage
Previous: KemiF, jan. 1996
Contents
Gert D. Billing
2002-07-01